Gli atomi sono caratterizzati da un nucleo, formato da protoni e neutroni, attorno al quale si muovono gli elettroni.
La quantità di energia che si deve fornire ad un elettrone per farlo staccare da un atomo gassoso è detta energia di ionizzazione. Per ogni elemento le energie di ionizzazione possono essere determinate sperimentalmente. Ovviamente se gli elettroni sono più vicini al nucleo, sarà necessaria una energia di ionizzazione maggiore.
Per esempio gli elettroni del magnesio si dividono in tre gruppi:
- due elettroni stanno nel livello più esterno, l'energia di ionizzazione è minore
- otto elettroni sono nel livello intermedio
- altri due stanno nel livello più interno, l'energia di ionizzazione è maggiore
Anche per tutti gli altri elementi si riscontra sempre una crescita progressiva.
Per definizione esistono in un atomo differenti livelli energetici in cui si distribuiscono gli elettroni.
Questi livelli sono chiamati strati o gusci elettronici.
Ogni strato ha un limite di elettroni:
Nel primo possono essercene soltanto due, nel secondo otto e nel terzo fino a 18. Se gli elettroni totali sono più di 18, il riempimento è meno regolare, perchè i confini tra i gusci sono più sfumati.
Il comportamento chimico di un elemento è legato al numero di elettroni presenti nel guscio più esterno, detto livello di valenza.
Gli atomi sono quasi sempre uniti con altri atomi per formare molecole o aggregati cristallini. Sono uniti perché si attraggono tra loro fino a quando le forze repulsive sono bilanciate con le forze attrattive.
Per definizione si dice legame chimico l'unione tra atomi, uguali o diversi, che dà luogo ad uno stato più stabile dal punto di vista energetico.
La distanza a cui si pongono due atomi varia in funzione della loro dimensione, del numero di elettroni, del tipo di legame che li unisce o, se fanno parte di una molecola più complessa, dell'influenza degli altri legami all'interno di questa.
Per definizione la distanza tra due atomi alla quale il sistema da loro costruito assume la minima energia si chiama distanza di legame
G.N. Lewis fu il primo che identificò negli elettroni del livello di valenza, anche chiamati elettroni di valenza, i responsabili dell'unione tra atomi.
La regola dell'ottetto dice che ogni atomo, secondo il numero dei suoi elettroni di valenza, tende a cedere, acquistare o mettere in comune un numero di elettroni tale da raggiungere un ottetto (un dueto per atomi vicini all'elio) completo nello strato più esterno.
Lewis ideò anche un sistema di raffigurazione che consiste nel rappresentare con dei puntini disposti intorno al simbolo dell'elemento che rappresentano solo gli elettroni di valenza dell'atomo, disponendone massimo 2 per lato, ma metterne due vicini solo dopo aver sistemato i primi 4 separatamente.
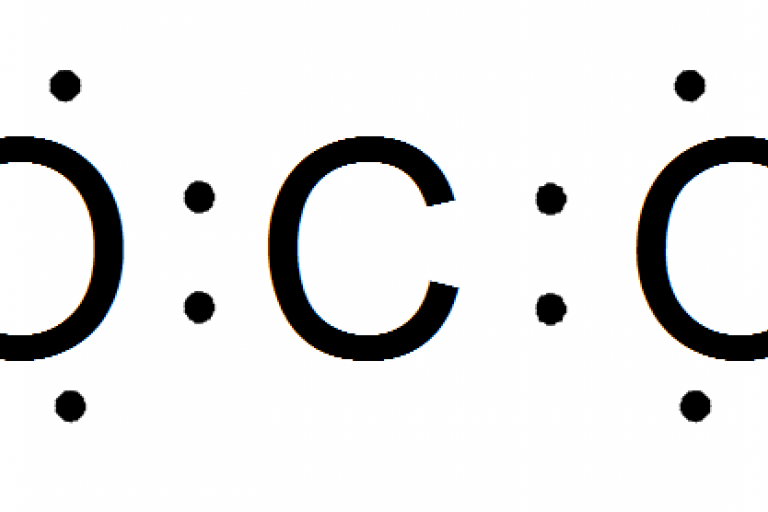
Esistono diversi tipi di legame chimico.
Il legame covalente è caratterizzato dalla compartecipazione (messa in comune) di una o più coppie di elettroni tra atomi vicini all'interno della stessa molecola.
